Científicos de la Universidad de California en Irvine (EE.UU.) presentaron el 23 de noviembre un mosquito modificado genéticamente para que no pueda transmitir la malaria. Si mosquitos de este tipo se liberan en regiones donde la malaria es endémica, se aparearían con mosquitos silvestres y transmitirían el gen de resistencia a la infección a las generaciones siguientes, con lo que los casos de malaria podrían reducirse de manera drástica.
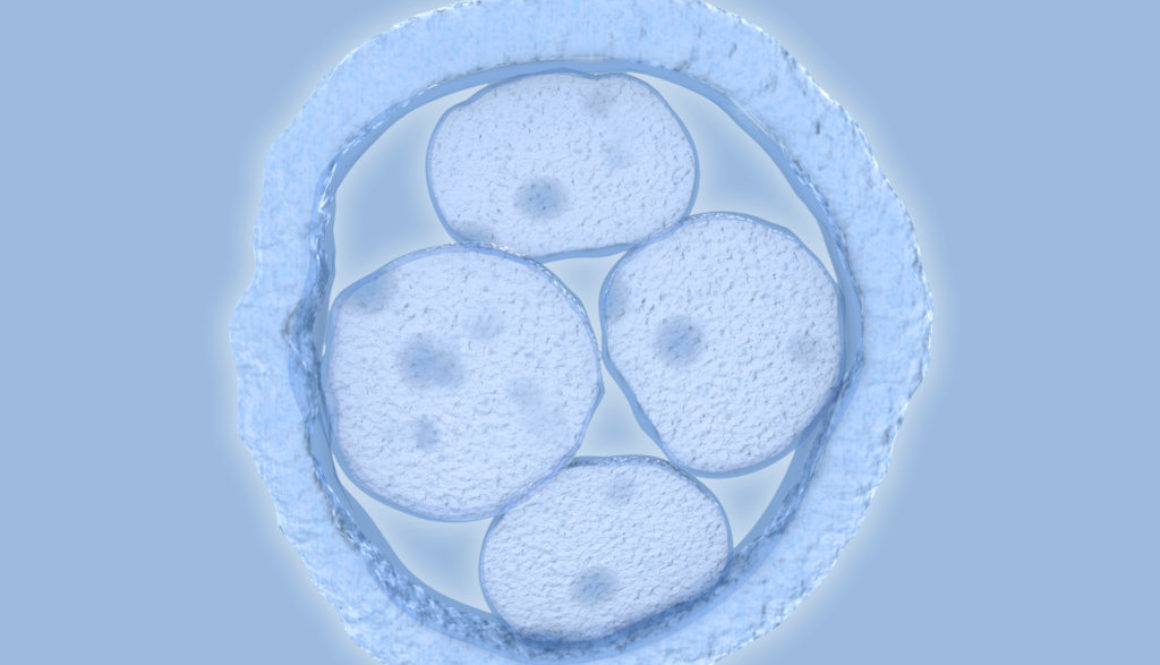
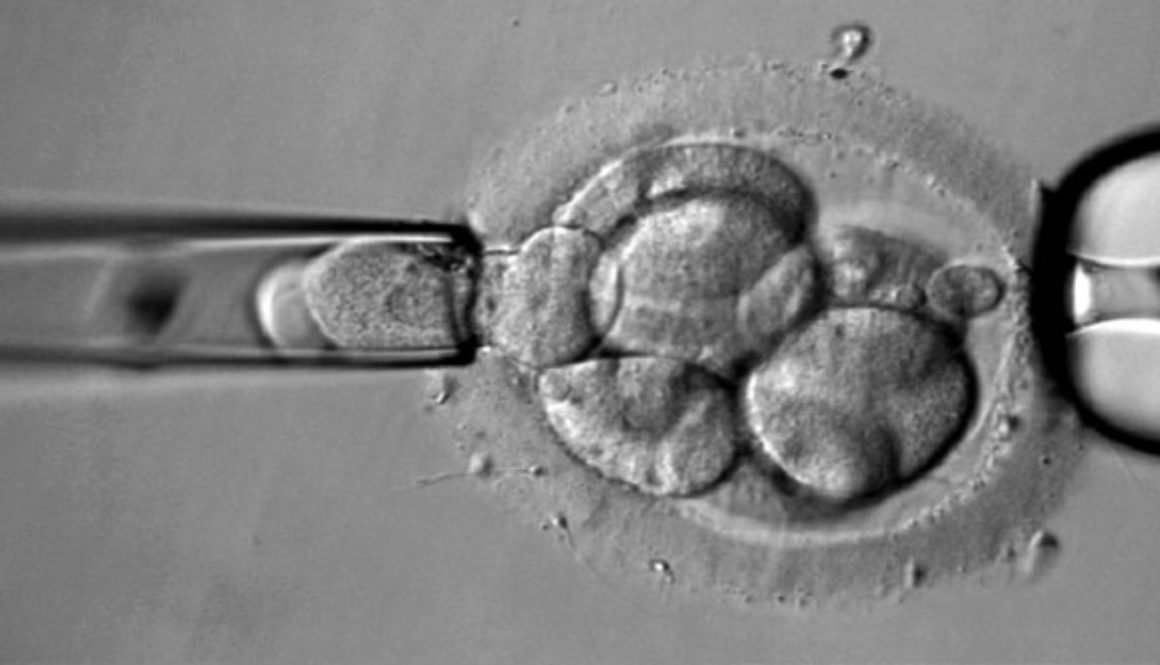
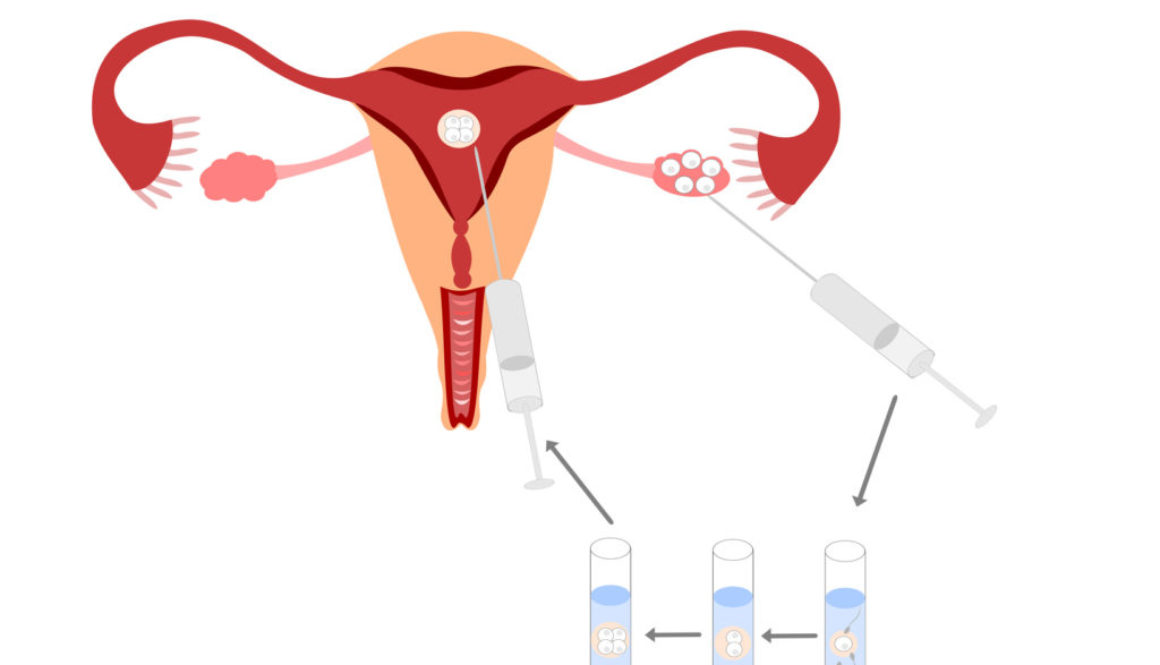
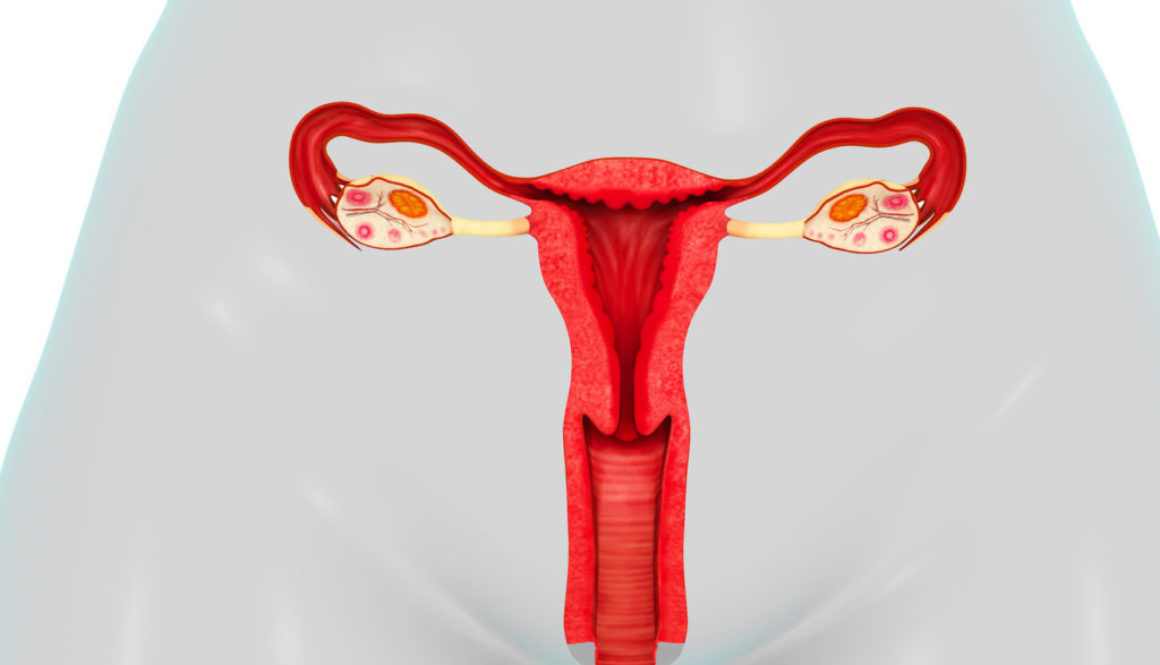
En el Reino Unido, un equipo científico ha solicitado autorización para modificar genéticamente embriones humanos, no para que nazcan bebés de diseño, sino en el marco de una investigación sobre el desarrollo embrionario.
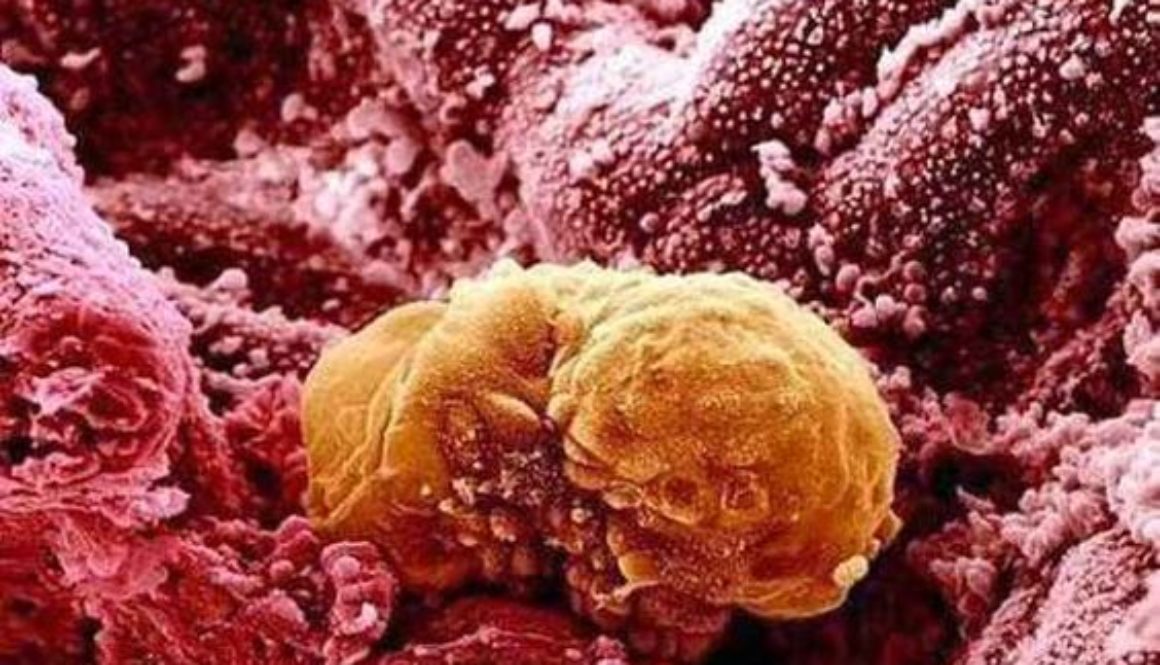
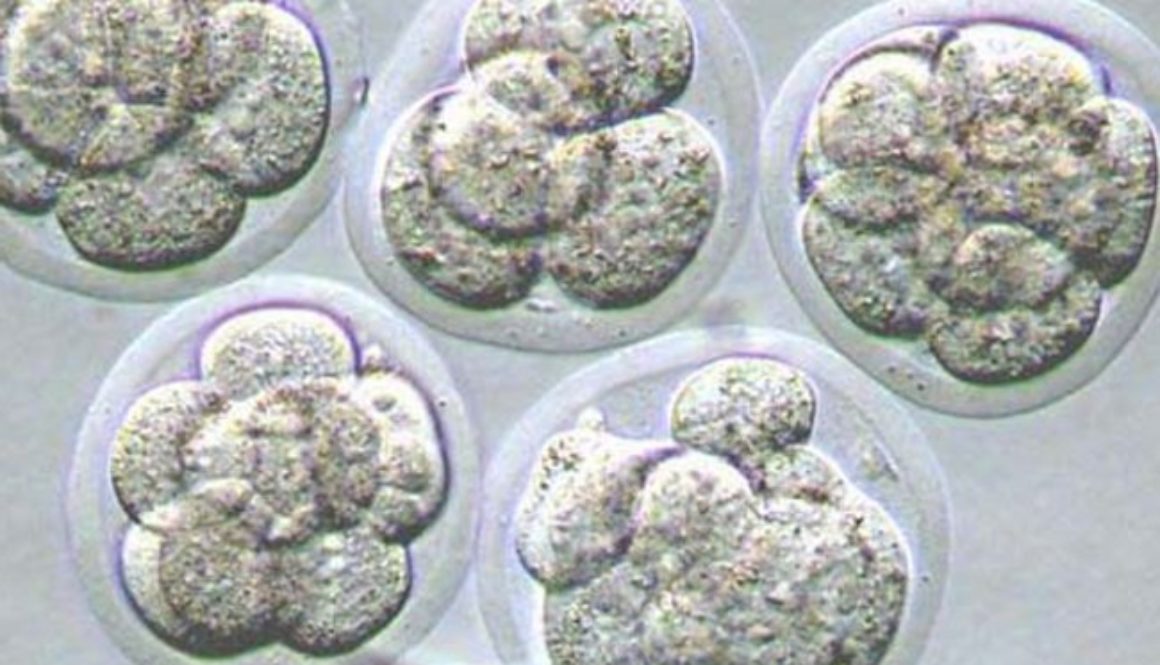
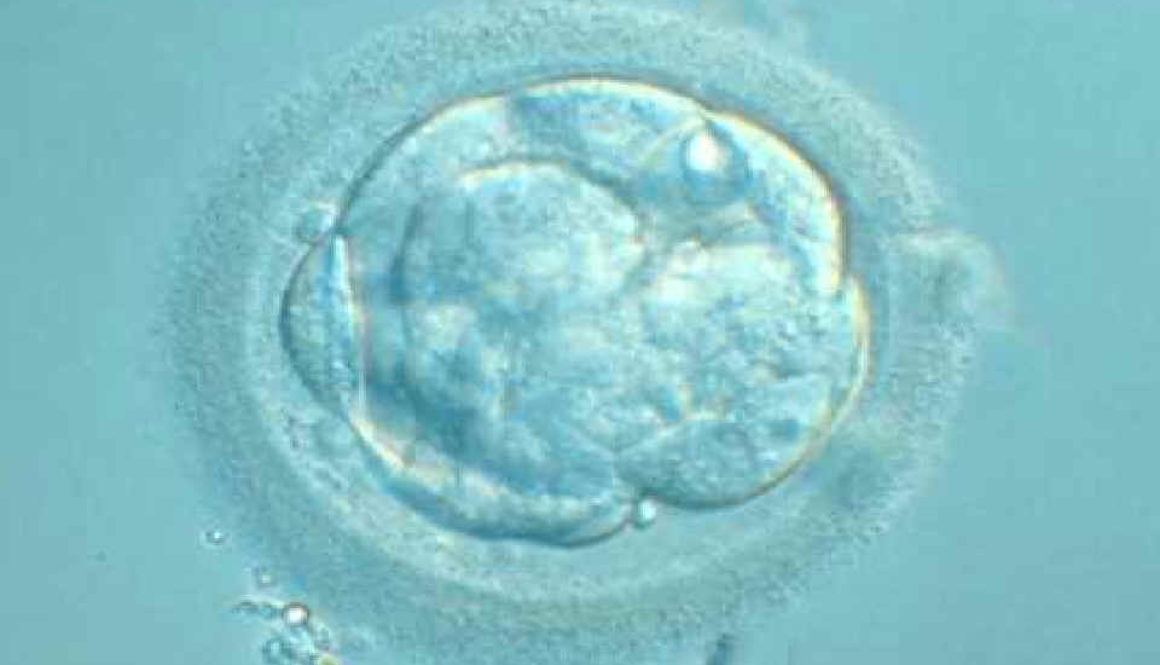
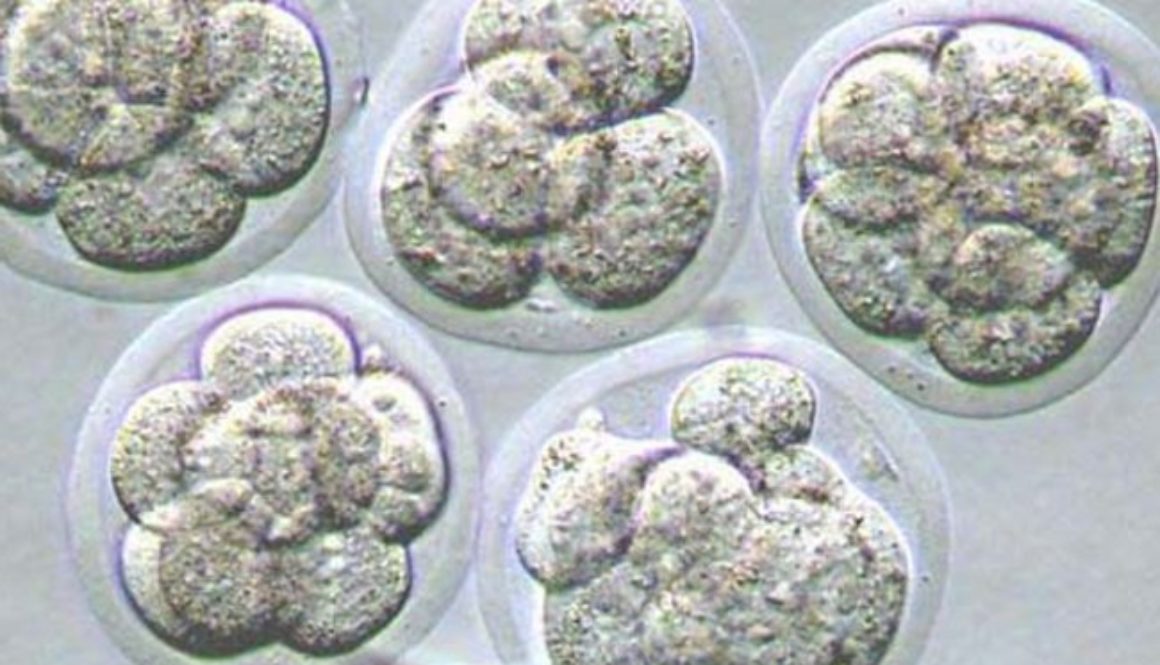
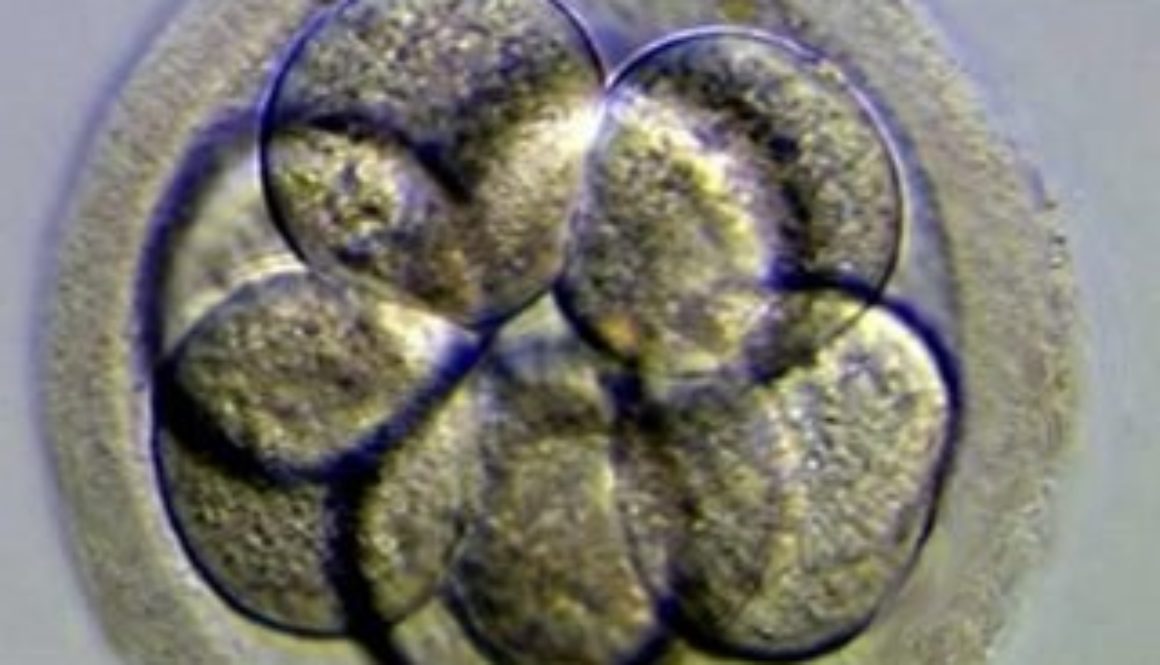
En China, otro equipo científico ha ido un paso más allá y ya ha modificado el ADN de un embrión humano, aunque se ha apresurado a aclarar que se trataba de un embrión inviable y por lo tanto no hubiera podido dar lugar al nacimiento de una persona.
Regresamos a EE.UU. Investigadores de la Escuela de Medicina de Harvard han eliminado genes dañinos de cerdos con el objetivo de trasplantar los órganos de los animales a personas.
Personas, mosquitos y cerdos. En Estados Unidos, el Reino Unido y China. Pero todas estas noticias tienen algo en común. Todas se basan en una nueva técnica de edición genética llamada CRISPR (pronunciar crísper). Y todas se han producido este año.
“Es una técnica con un potencial enorme, se está extendiendo muy rápido”, declara Stephen Forrow, uno de los primeros investigadores que la ha adoptado en el Institut de Recerca Biomèdica (IRB) de Barcelona.
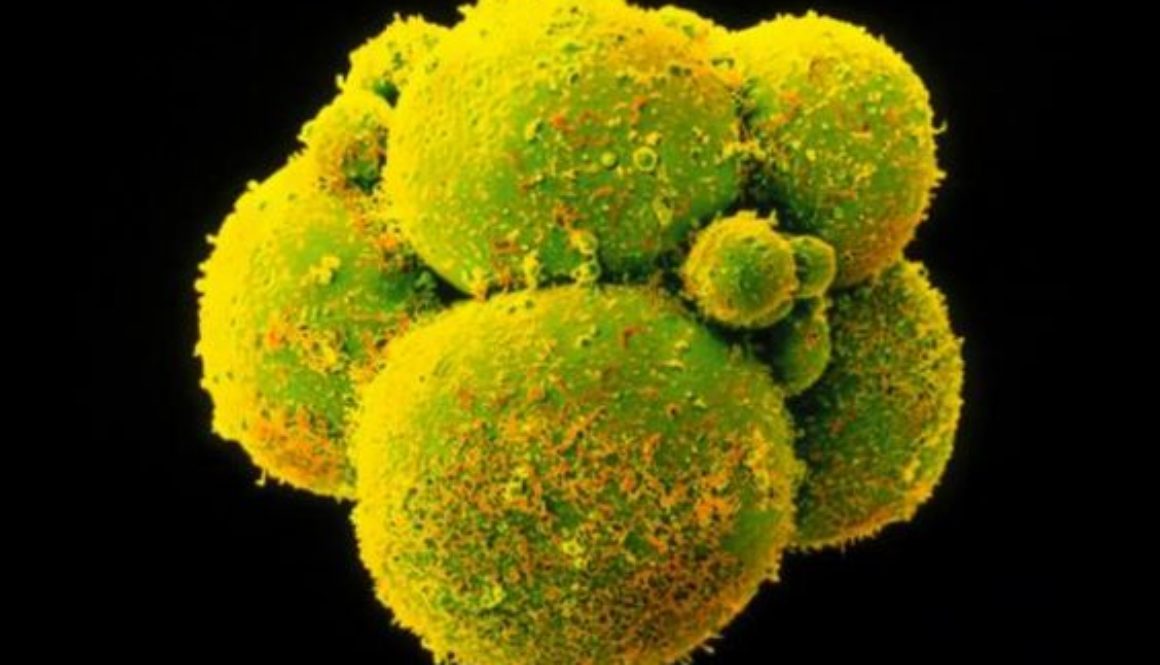
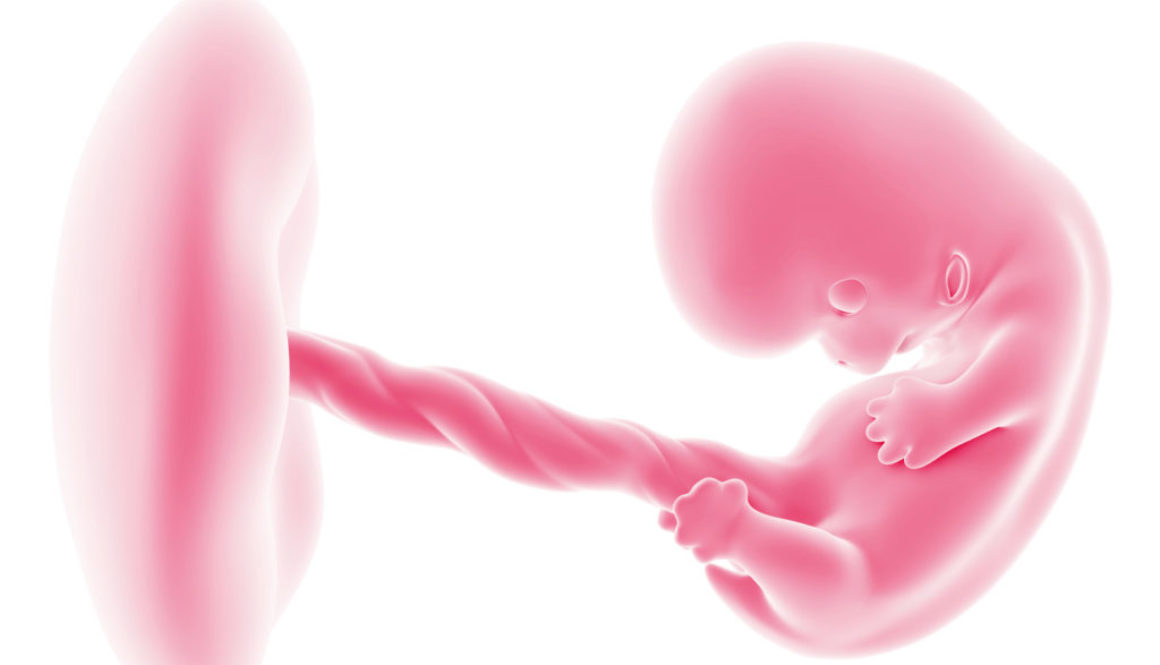
Las aplicaciones incluyen curar enfermedades, mejorar cosechas, modificar animales de granja, diseñar flores de colores… Cualquier aplicación en la que pueda ser útil eliminar o añadir un gen. Y, por supuesto, también modificar óvulos, espermatozoides y embriones humanos para prevenir enfermedades o alterar cualquier otra característica.
“Es una revolución porque, con CRISPR, modificar el genoma se ha vuelto mucho más fácil”, declara Luis Serrano, director del Centre de Regulació Genòmica (CRG) en Barcelona. “Tenemos otras técnicas de edición genética desde hace años. La diferencia es que CRISPR es rápida, barata y fácil de utilizar”.
Precisamente porque está al alcance de cualquier laboratorio, han surgido las primeras voces que han alertado sobre un uso inadecuado de la técnica después de que científicos chinos anunciaran en abril que habían editado el ADN de un embrión humano.
El comité de bioética de la Unesco reclamó en octubre una moratoria para no aplicar por ahora la edición genética a óvulos, espermatozoides y embriones humanos, dado que las alteraciones se transmitirían a las generaciones siguientes y la técnica podría tener consecuencias indeseadas. La Unesco defendió en un informe que la “ingeniería del genoma es prometedora”, pero que “las intervenciones sobre el genoma deberían autorizarse únicamente por motivos de prevención, diagnóstico y terapia, y sin que implique modificaciones para la descendencia”.
Pero no todos los investigadores están de acuerdo con una moratoria como la que propone la Unesco. Del martes al jueves de esta semana se ha celebrado en Washington la Cumbre Internacional de Edición Genética Humana, en la que investigadores de más de veinte países han debatido si la técnica CRISPR debe regularse y cómo. La reunión ha estado coorganizada por las Academias Nacionales de Ciencias y de Medicina de EE.UU., la Academia Nacional de Ciencias de China y la Sociedad Real del Reino Unido, lo que indica la voluntad de alcanzar un acuerdo entre los tres países más activos en el uso de CRISPR.
“Estamos cerca de poder modificar la herencia humana. Esto es algo a lo que la gente debe prestar atención”, afirmó el martes en la jornada inaugural David Baltimore, premio Nobel del Instituto de Tecnología de California y principal organizador de la reunión, en declaraciones recogidas por Associated Press.
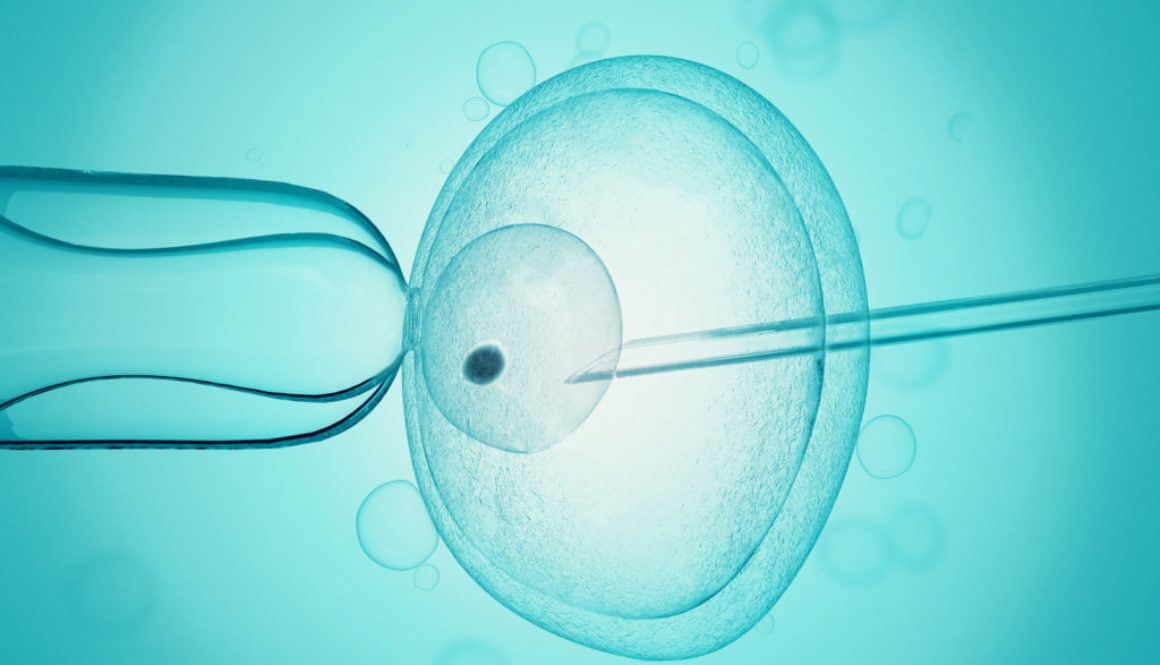
La fiebre por CRISPR empezó en el 2012 cuando la investigadora estadounidense Jennifer Doudna y la francesa Emmanuelle Charpentier demostraron, en una investigación conjunta, que la técnica puede emplearse para editar el ADN humano. En origen, CRISPR es un mecanismo de defensa de las bacterias frente a los virus. Dado que algunos virus insertan sus genes en el ADN de las bacterias, y de este modo se aprovechan de ellas para fabricar nuevos virus, algunas bacterias han aprendido a identificar y eliminar los genes invasores que les han entrado en el genoma.
Lo hacen mediante unas herramientas genéticas que identifican al enemigo acoplándose al ADN procedente del virus. Se las llama CRISPR porque son las iniciales, en inglés, de “repeticiones palindrómicas cortas agrupadas regularmente intercaladas”. Pero el nombre no es importante. Lo que importa es que las CRISPR actúan como guías que encuentran los genes indeseables. Y que, una vez los han encontrado, las bacterias utilizan unas proteínas llamadas Cas9, que actúan como tijeras, para cortar el ADN y eliminarlos.
Doudna y Charpentier tuvieron la gran idea de diseñar guías genéticas, similares a las CRISPR de las bacterias, pero adaptadas al ADN humano. Y de equiparlas con la proteína Cas9 para cortar el ADN en el lugar adecuado.
En realidad, estas nuevas guías desarrolladas por Doudna y Charpentier ya no son secuencias como las de las bacterias. Son, simplemente, guías genéticas diseñadas en laboratorio. Pero se las sigue llamando CRISPR por el mecanismo biológico en el que se inspiran.
La técnica aún debe perfeccionarse, según reconocen los investigadores que trabajan con ella y las compañías que ya se han creado para explotarla comercialmente. Aunque tiene una alta precisión, no es infalible, y puede crear mutaciones en lugares equivocados del genoma –las llamadas mutaciones off target, porque no dan en la diana-.
Esta es una de las razones principales por las que algunos científicos son contrarios a la edición genética de óvulos, espermatozoides y embriones humanos por ahora. Entre ellos se encuentra Emmanuelle Charpentier: “Mientras [las herramientas] no estén a punto, pienso que es bueno tener una prohibición de editar la línea germinal humana”, declaró el miércoles en Washington a la agencia Reuters.
Otros investigadores, como Jennifer Doudna, defienden una posición menos drástica: “Una prohibición total no es práctica teniendo en cuenta la accesibilidad y la facilidad de uso de CRISPR/Cas9”, afirma en un artículo publicado ayer en Nature. También ayer, el Comité de Bioética del Consejo de Europa hizo pública una declaración en la que defiende la técnica para mejorar la prevención, diagnóstico y tratamiento de enfermedades, pero se pronuncia en contra de “cualquier modificación genética de embriones que se vaya a transmitir a próximas genera-
ciones”.
Esta opinión es compartida por el Gobierno de EE.UU. La modificación genética en reproducción asistida “es una línea que no debería cruzarse en este momento”, ha declarado John Holdren, representante de la Casa Blanca, en la reunión de Washingon. Pero cualquier acuerdo que se adopte debería ser internacional porque. según Holdren, la técnica se está extendiendo tan rápido que lo que se haga en un país “tendrá consecuencias en otros”.